第I卷
1.化学与生产、生活息息相关, 下列叙述错误的是
A.铁表而镀锌可以增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含再金属离子的电镀废液不能随意排放
2.实验室制备下列气体时,所用方法正确的是
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
3.运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
4.对右图两种化合物的结构或性质描述正确的是
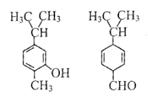
A.不是同分异构体
B.分子中共平面的碳原了数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
5.下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
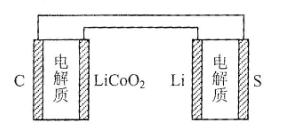
6.已知:锂离子电池的总反应为:LixC+Li1-xCoO2放电充电C+LiCoO2,锂硫电池的总反应为:2Li+S放电充电Li2S,有关上述两种电池说法正确的是
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
第II卷
7.(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 ___________ 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ___________,氧化性最弱的简单阳离子是___________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
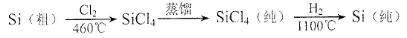
写出SiCl4的电子式:___________;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 ___________。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___________。
8.(18分)从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:
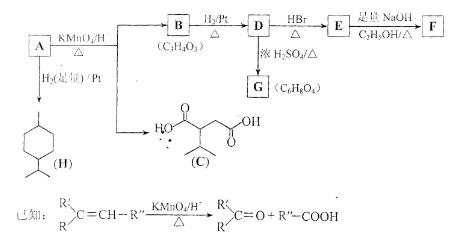
(1)H的分子式为 ___________。
(2)B所含官能团的名称为___________ 。
(3)含两个—COOCH3基团的C的同分异构体共有___________ 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 ___________。
(4)B→D,D→E的反应类型分别为___________ 、___________。
(5)G为含六元环的化合物,写出其结构简式:___________ 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为___________。
(7)写出E→F的化学方程式:_________________________________ 。
(8)A的结构简式为 ___________,A与等物质的量的Br2进行加成反应的产物共有___________ 种(不考虑立体异构)。
9.(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
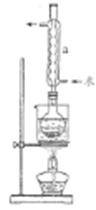
I.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)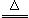 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是___________。
(2)仪器a的名称是___________,其作用是___________ 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___________,检验是否存在该杂质的方法是___________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:___________ .
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化:___________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M)_________ 。

III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 ___________________。
10.(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)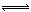 2NH3(g) ∆H=—92.4kJ•mol‾1,一种工业合成氨的简易流程图如下:
2NH3(g) ∆H=—92.4kJ•mol‾1,一种工业合成氨的简易流程图如下:
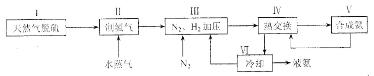
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________。
(2)步骤II中制氯气原理如下:
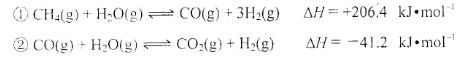
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 ___________________。
(3)图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___________________。
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
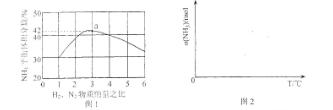
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号)___________________,简述本流程中提高合成氨原料总转化率的方法:___________________ 。











