二、选择题(本题共5小题,每小题有一个或二个选项符合题意。错选、多选不给分。有二个答案的,只选一个且正确,给1分。每小题2分,共10分)
16.(2分)(2013•南京)下列叙述正确的是( )
A. 将生锈的菜刀浸泡在食盐水中,可除去其表面的铁锈
B. 通过相互刻画的方法,发现铜片的硬度比黄铜片大
C. 淬火后的缝衣钢针不能弯曲
D. 用食醋可除去热水壶内壁的水垢
考点: 金属锈蚀的条件及其防护;合金与合金的性质;酸的化学性质.
专题: 金属与金属材料;常见的酸 酸的通性.
分析: 金属氧化物不能和盐反应;
两种物质相互刻划时,痕迹明显的物质硬度较小;
钢淬火后的强度、硬度进一步提高;
显酸性的物质能和显碱性的物质反应,也能够和碳酸盐反应.
解答: 解:A、铁锈的主要成分是氧化铁,氧化铁不能和食盐反应,所以不能用食盐水除铁锈.错误.
B、通过相互刻画的方法,发现铜片的痕迹比黄铜的痕迹明显,说明铜片的硬度比黄铜片的硬度小.错误.
C、淬火后的缝衣钢针,硬度和强度都提高了,不能弯曲.正确.
D、食醋中含有醋酸,醋酸显酸性,能和水垢中的碳酸钙、氢氧化镁反应,从而除去水垢.正确.
故选:CD.
点评: 某些物质经过处理后,性质发生了改变,例如铜制成合金黄铜后,硬度增大;金属淬火后硬度、强度提高.
17.(2分)(2013•南京)据报道,“毒淀粉”是在淀粉中添加了对人体有害的马来酸(C4H4O4).马来酸是无色晶体,能溶于水.下列关于马来酸的说法中正确的是( )
A. 马来酸属于氧化物
B. 马来酸由三种元素组成
C. 马来酸中碳元素的质量分数最大
D. 5%的马来酸溶液中氧元素的质量分数为2.76%
考点: 化学式的书写及意义;从组成上识别氧化物;元素的质量分数计算.
专题: 化学用语和质量守恒定律.
分析: A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物.
B、根据马来酸化学式的含义进行分析判断.
C、根据化合物中元素的质量分数= ×100%,进行分析判断.
×100%,进行分析判断.
D、5%的马来酸溶液中含有90%的水,水中氧元素的质量分数为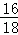 ×100%≈88.9%,则马来酸溶液的水中氧元素的质量分数为90%×88.9%=80%,进行分析判断.
×100%≈88.9%,则马来酸溶液的水中氧元素的质量分数为90%×88.9%=80%,进行分析判断.
解答: 解:A、马来酸是由碳、氢、氧三种元素组成的,不属于氧化物,故选项说法错误.
B、马来酸是由碳、氢、氧三种元素组成的,故选项说法正确.
C、马来酸中碳原子的相对原子质量之和为12×4=48,氢原子的相对原子质量之和为1×4=4,氧原子的相对原子质量之和为16×4=64,氧元素的相对原子质量之和最大,则氧元素的质量分数最高,故选项说法错误.
D、5%的马来酸溶液中含有90%的水,水中氧元素的质量分数为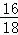 ×100%≈88.9%,马来酸溶液的水中氧元素的质量分数为90%×88.9%=80%,马来酸中还含有氧元素,故5%的马来酸溶液中氧元素的质量分数大于80%,故选项说法错误.
×100%≈88.9%,马来酸溶液的水中氧元素的质量分数为90%×88.9%=80%,马来酸中还含有氧元素,故5%的马来酸溶液中氧元素的质量分数大于80%,故选项说法错误.
故选B.
点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.
18.(2分)(2013•南京)甲、乙两种不含结晶水的固体物质溶解度曲线如图,下列说法中不正确的是( )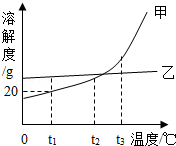
A. t1℃时,50g甲的饱和溶液中溶解了10g的甲
B. 将t2℃甲、乙两种物质的饱和溶液升温至t3℃(溶剂的量不变),两种溶液中溶质的质量分数相等
C. t2℃时,要使接近饱和的乙溶液达到饱和状态,可采用蒸发溶剂的方法
D. 分别将t2℃甲、乙两种物质的溶液降温至t1℃,一定都有晶体析出
考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
专题: 溶液、浊液与溶解度.
分析: A、根据t1℃时,甲的溶解度进行计算;
B、根据t2℃时甲、乙两种物质的溶解度分析计算;
C、根据饱和溶液与不饱和溶液的转化方法分析;
D、根据溶解度随温度的变化情况分析.
解答: 解:A、由甲的溶解度曲线可知,在t1℃时,甲的溶解度是20g,由溶解度的意义可知,在60g甲的饱和溶液中溶解了10g的甲.故A说法不正确;
B、由甲、乙两种物质溶解度曲线可知,在t2℃时甲、乙两种物质的溶解度相等,溶液的溶质的质量分数相等.在升高温度时,甲、乙的溶解度都随温度的升高而增大,溶液都由饱和溶液变为不饱和溶液,溶液中溶质、溶剂质量不变,两种溶液中溶质的质量分数相等.故B说法正确;
C、t2℃时,要使接近饱和的乙溶液达到饱和状态,可采用蒸发溶剂的方法.故C说法正确;
D、由于在t2℃时,甲、乙两种物质的溶液不一定是饱和溶液,所以,在降温至t1℃时,不一定都有晶体析出.故D说法不正确.
故选AD.
点评: 本题难度不是很大,会根据固体溶解度曲线所表示的意义及溶解度随温度变化的情况解决相关的问题,培养学生解决问题的能力.
19.(2分)(2013•南京)除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是( )
A. CaCO3固体(CaO固体)﹣﹣高温煅烧
B. N2气体(O2气体)﹣﹣通过灼热的铜网
C. CO气体(CO2气体)﹣﹣依次通过浓硫酸和足量的氢氧化钠溶液
D. KCl溶液(CaCl2溶液)﹣﹣滴加碳酸钠溶液至恰好完全反应,过滤
考点: 物质除杂或净化的探究.
专题: 物质的分离、除杂、提纯与共存问题.
分析: 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答: 解:A、CaCO3固体高温下分解生成氧化钙和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,故选项所采取的方法正确.
C、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,应先通过氢氧化钠溶液,再通过浓硫酸除去水分,故选项所采取的方法错误.
D、CaCl2溶液能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项所采取的方法错误.
故选B.
点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.
20.(2分)(2013•南京)下表所示各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是( )
物质 选项 | 甲 | 乙 | 丙 | 丁 |
A | CO2 | CaCO3 | H2O | O2 |
B | NaOH | NaCl | CO2 | Na2CO3 |
C | H2O2 | H2O | O2 | MgO |
D | CaO | Ca(OH)2 | H2O | CaCl2 |
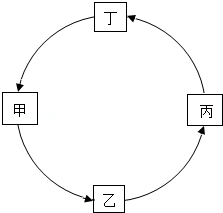
A. A B. B C. C D. D
考点: 物质的相互转化和制备.
专题: 物质的制备.
分析: 根据各组物质的化学性质及变化规律,分析各组物质间能按转化关系图通过一步反应就能实现一组;通过列出具体的反应,可以使分析和判断变得直观、简单.
解答: 解:A、二氧化碳与氢氧化钙反应能一步得到碳酸钙,碳酸钙与稀盐酸反应能一步得到水,水通电分解能一步得到氧气,氧气和碳反应能得到二氧化碳.故A符合题意;
B、由于氯化钠不能通过一步反应得到二氧化碳.故B不符合题意;
C、由于氧化镁不能通过一步反应得到过氧化氢.故C不符合题意;
D、由于水不能通过一步反应得到过氯化镁.故D不符合题意.
故选A.
点评: 本题考查了物质转化关系的分析判断,物质性质的熟练应用,物质转化关系的反应条件选择是解题的关键,题目难度中等.
三、(本题包括2小题,共13分)
21.(10分)(2013•南京)请根据下列装置图,回答有关问题:
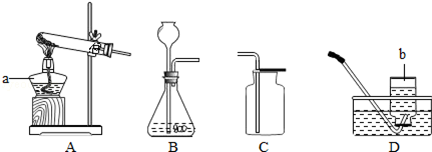
(1)写出装置图中标号仪器的名称:a 酒精灯 ,b 集气瓶 .
(2)写出实验室用高锰酸钾制取氧气的化学方程式 2KMnO4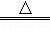 K2MnO4+MnO2+O2↑ ,可选用的发生装置是 A (填字母).
K2MnO4+MnO2+O2↑ ,可选用的发生装置是 A (填字母).
(3)写出实验室用锌粒与稀硫酸制取氢气的化学方程式 Zn+H2SO4=ZnSO4+H2↑ ,可选用的收集装置是 D (填字母).
(4)若要配置245g质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸(密度为1.84g/cm3) 13.6 mL(计算结果保留一位小数),由浓溶液配制稀溶液时,计算的依据是 溶液稀释前后,溶质的质量不变 .在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 量取 、混匀、冷却至室温装瓶并贴上标签.
考点: 常用气体的发生装置和收集装置与选取方法;一定溶质质量分数的溶液的配制.
专题: 溶液、浊液与溶解度;常见气体的实验室制法、检验、干燥与净化.
分析: (1)据常用仪器回答;
(2)据高锰酸钾制取氧气的反应原理书写方程式,并据反应物状态和反应条件选择发生装置;
(3)据锌和稀硫酸反应原理书写方程式,据氢气的密度和溶解性选择收集装置;
(4)用水稀释浓溶液成稀溶液的过程中,溶质的质量不变,溶液的质量=溶液的密度×溶液的体积,据此列等式计算,并据配制溶液的步骤分析解答.
解答: 解:(1)标号仪器分别是酒精灯和集气瓶;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,方程式是:2KMnO4 K2MnO4+MnO2+O2↑,该反应需要加热,属于固体加热型,故选发生装置A;
K2MnO4+MnO2+O2↑,该反应需要加热,属于固体加热型,故选发生装置A;
(3)锌和稀硫酸反应生成硫酸锌和氢气,方程式是:Zn+H2SO4=ZnSO4+H2↑,氢气的密度比空气小,应用向下排空气法收集,氢气难溶于水,所以还可用排水法收集;
(4)根据配制前后溶液中的溶质质量不变,设需要98%浓硫酸溶液的体积为V,则有:245g×10%=98%×1.84g/cm3×V,解得V=13.6mL;在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、量取浓硫酸和水,然后混匀、冷却至室温装瓶并贴上标签;
故答案为:(1)酒精灯;集气瓶;
(2)2KMnO4 K2MnO4+MnO2+O2↑;A;
K2MnO4+MnO2+O2↑;A;
(3)Zn+H2SO4=ZnSO4+H2↑;D;
(4)13.6;溶液稀释前后,溶质的质量不变;量取.
点评: 发生装置据反应物状态和反应条件进行选择,收集装置依据气体的密度和溶解性进行选择,此外,掌握实验室制取氢气、氧气的反应原理,溶液配制的相关知识,才能得出正确的答案.
22.(3分)(2013•南京)铁是应用最广泛的金属.
(1)写出铁丝在氧气中燃烧的化学方程式 3Fe+2O2 Fe3O4 .
Fe3O4 .
(2)新型材料纳米级Fe粉能用作高效催化剂.实验室采用还原法制备纳米级Fe粉,其流程如图所示:
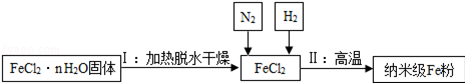
①纳米级Fe粉在空气中易自燃.实验中通入N2的目的是 防止生成的纳米级铁粉被氧化 .
②写出Ⅱ中H2还原FeCl2置换出铁的化学方程式 H2+FeCl2 Fe+2HCl .
Fe+2HCl .
考点: 金属的化学性质;物质的相互转化和制备.
专题: 金属与金属材料.
分析: (1)根据铁在纯氧中燃烧生成四氧化三铁进行解答;
(2)根据题干可知,生成纳米级Fe粉是由氢气高温还原氯化亚铁得到的,以及在高温下生成的铁易被氧气氧化,故需要使用保护气.
解答: 解:(1)铁在纯氧中燃烧生成四氧化三铁,反应的化学方程式:3Fe+2O2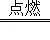 Fe3O4;(2)在高温条件下生成的铁易被氧气氧化,故需要使用保护气,防止铁粉与空气中的氧气接触自燃;在高温的条件下,H2与FeCl2反应,可生成纳米铁粉和氯化氢气体,反应的方程式为:H2+FeCl2
Fe3O4;(2)在高温条件下生成的铁易被氧气氧化,故需要使用保护气,防止铁粉与空气中的氧气接触自燃;在高温的条件下,H2与FeCl2反应,可生成纳米铁粉和氯化氢气体,反应的方程式为:H2+FeCl2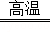 Fe+2HCl;
Fe+2HCl;
故答案为:(1)3Fe+2O2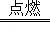 Fe3O4;
Fe3O4;
(2)防止生成的纳米级铁粉被氧化;H2+FeCl2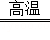 Fe+2HCl.
Fe+2HCl.
点评: 本题考查了金属铁的有关性质,完成此题,可以结合题干提供的信息和已学的铁的有关性质进行解答.











